摘要: 過程分析技術(PAT)由US FDA最先提出,旨在使用先進的生產過程工藝來實現經濟和高質的藥品生產。
什麼是 PAT?
1)PAT 最終指南發表於 2004 年 9 月,其目標是鼓勵自主研發和實施醫藥開發、製造及品質保證,代表著 FDA 對未來醫藥產品研製和製造的遠景。
2)“這是一個以保證最終產品品質為目標,用於設計、分析、並通過及時測量
(就是說在加工過程中)原材料、在加工材料以及生產過程的關鍵品質和性能屬性來控制製造過程的系統。”
3)PAT 依據的原則是:”產品品質不是被測試得來,而是被製造出來或設計出來的。“
製程分析技術(PAT)已有多年的實施,尤其是在化學工業用於化學工藝程序控製。近來,PAT已成為美國食品藥品部門(US FDA)品質源於設計(QbD)行為計畫的基石,旨在設計與控製有品質保證的製程。為此,製藥業也在積極地使用PAT工具。PAT工具即可用在實驗室、也可用在生產上,其實驗室應用注重於設計出有品質保證的製程而生產上的使用主要是監測與控制製程。
為了鼓勵製藥業者發展創新性的藥物開發、製造、與品保等技術,先進國家的藥政機構如 US FDA近年來提出製藥程序分析技術(Process Analytical Technology;簡稱 PAT)的規 範準則予以協助。而在日益競爭的國際製藥業中,如何在符合藥政規範下完成開發先進技 術,達成「品質源於設計」(Quality-by-Design)的目的,更是各廠維持高度競爭力的利器。
製程分析技術(Process Analytical Technology;PAT)之 GMP 觀點 PAT 為透過生產線上即時量測製程中關鍵指標的品質或狀況,來設計、分析與管控製程的系統,藉以確保製造之產品品質的一致性。PAT 可作為製程分析、製程管制與品質持續改善的工具,甚至可應用 PAT 技術進行即時管控(Real Time Control)或線上放行(Real Time Release)。
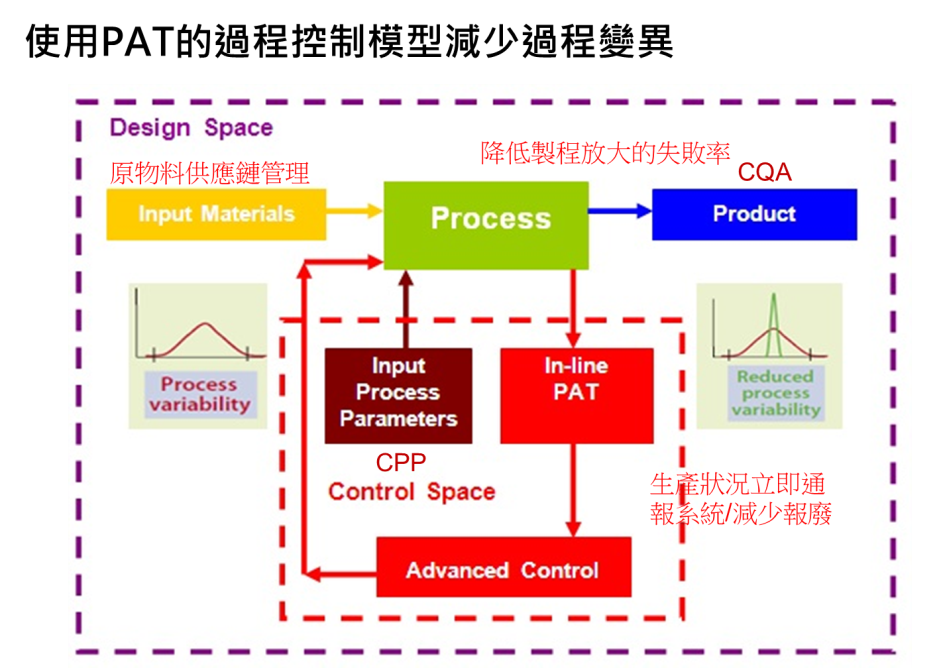
基於品質源於設計(QbD)的理念,產品的品質無法在最終測試時才注入,況且,倘若最後製造完成時發現測試不合格,將造成極大的浪費或損失,因此美國FDA開始提倡製程分析技術(Process Analytical Technology,PAT)之管控方式(圖三),
藉由產品設計空間的觀念找出關鍵品質特性外(CQA),也藉由對製程科學理論的清楚瞭解進而掌控制程,並對關鍵步驟,設定關鍵製程因數(CPP)作即時管控(Real Time Control),利用作業線上之即時檢驗技術,偵測製程中各階段藥品之品質,瞭解中間產品之品質監測(如鑑別、純度、效價…),以確保每個步驟均在預期範圍之內。
PAT的中心思想其實已充分結合藥品研究發展過程與實際製造過程,也結合了FDA審查與cGMP稽核所著重的關鍵點,若前置作業管控良好,甚至可考慮產品即時放行之可能性。
工業PAT技術:
1)多變量數據採集與分析: DOE實驗設計,在開發過程中找到關鍵工藝過程變量
2)統計過程分析控制圖SPC Control Chart
實驗設計課程介紹: http://www.musigmagroup.com/tw/shownews-33.html
關鍵字: 製藥業、过程分析技术(PAT)、FDA、實驗設計、DOE、QbD、品質源於設計、P圖、CQA、CPP、PAT、Process Analytical Technology、品質保證、品質源於設計、一致性、即時管控.、即時管控、設計空間、關鍵品質特性外(CQA)、製程科學理論、關鍵製程因數、即時放行、控制圖、SPC